Maximum quantity allowed is 999
がんと糖鎖
がんは遺伝子変異やエピジェネティックな変化の蓄積により細胞が異常に増殖し、がん細胞が免疫監視から逃避することで起きる疾患です。悪性度の高いがんではがん細胞は周囲の組織に浸潤し、遠隔臓器に転移します。早期発見・早期治療により死を防げるがんもある一方、非常に予後の悪いがんもあり、より良い診断法の確立と治療法の開発が極めて重要です。
糖鎖は細胞表面や組織中に存在し、細胞接着や認識、細胞内および細胞間シグナリングや胚の発生に重要な役割を果たします。がん細胞やがん組織では糖鎖の構造や量が変化しており、このような変化はがんの進展に重要です。このため、これらの糖鎖は診断のバイオマーカーや治療の標的として期待されています。
弊社では、がん研究に有用な糖鎖関連試薬を豊富にラインナップしています。
※掲載の製品はすべて試薬です。研究用のみにご使用ください。
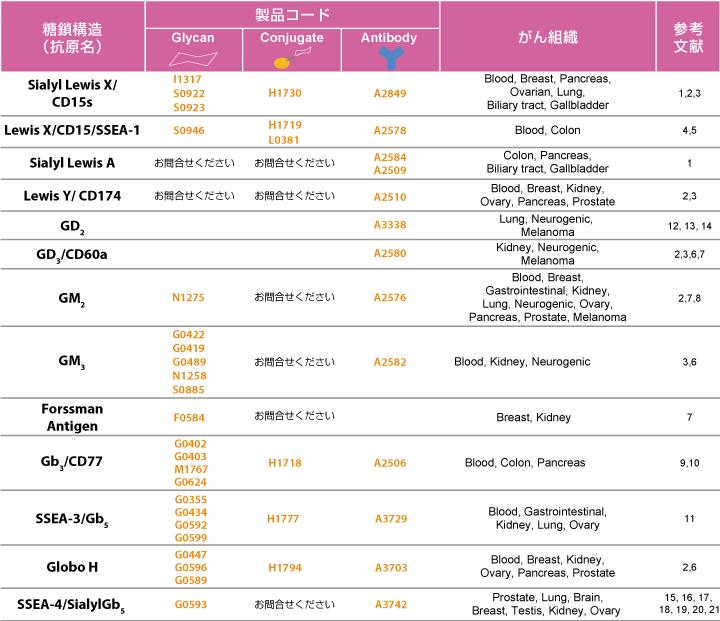
腫瘍マーカー・がん関連糖鎖抗原と関連試薬
細胞の糖鎖プロファイルはがん化により変化します。これらの糖鎖構造はがん関連糖鎖抗原と呼ばれ、中には腫瘍マーカーとして使われているものもあります。またがん関連糖鎖抗原はワクチン、免疫療法および治療用抗体のターゲットになると期待されています。
弊社は糖鎖・糖鎖コンジュゲート・抗体で、がん関連糖鎖抗原の研究をサポートしています。
使用例:抗糖鎖抗体による腫瘍マーカーの検出
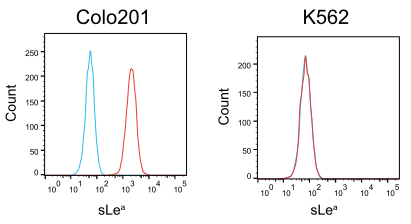
Sialyl Lewis A (sLea)は腫瘍マーカーのCA19-9として知られる糖鎖抗原です。
Colo201細胞株およびK562細胞株を、Anti-Sialyl Lewis A Monoclonal Antibody (1H4)(製品コード:A2584)(赤線)またはアイソタイプコントロール(青線)で染色後に、Goat Anti-Mouse IgG R-PE Conjugate(製品コード:G0569)で染色し、フローサイトメーターで解析しました。Colo201ではsLeaが発現し、K562では検出されないことが分かります。
がんの糖鎖解析試薬・グライコーム研究試薬
がん細胞の糖鎖プロファイルの変化を解析することは、がんの理解に非常に重要です。弊社では糖鎖の検出に利用できるレクチン、オリゴ糖を切り出す酵素エンドグリコシダーゼ、合成糖鎖などの、糖鎖の解析に有用な試薬を豊富にラインナップしています。
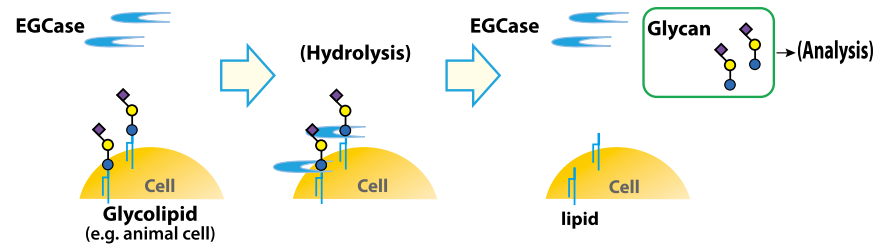
関連製品
レクチン
エンドグリコシダーゼ
合成糖鎖
がんの免疫療法研究試薬
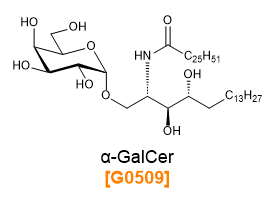
α-ガラクトシルセラミド(α-GalCer)は、海綿の一種であるAgelas mauritianusから抽出されたスフィンゴ糖脂質の誘導体です22-24)。抗原提示分子であるCD1dと複合体を形成し、免疫細胞のNKT細胞(NK細胞とT細胞の両方の性質を合わせ持つ細胞)のTCRのリガンドとしてNKT細胞を活性化、多種のサイトカインを産生させ免疫賦活・免疫抑制両方の反応を誘導します25-28)。これらの特徴から、これまでにα-GalCerを利用したがんの免疫療法の研究が進められています29)。 弊社ではこの他にも、がんワクチン療法などの免疫療法研究に有用な化学合成糖鎖抗原を提供しております。
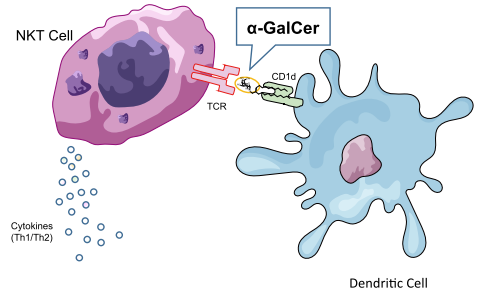
関連製品
がんの細胞外小胞とその関連試薬
細胞外小胞は様々な細胞から分泌される脂質二重膜の小胞です。生理的・病理的条件下で産生され、体液中や細胞培養上清中に存在し、標的細胞に取り込まれます。核酸やタンパク質などの機能性分子を内包するほかに、表面には糖鎖も存在し、がんの転移と深く関わります。
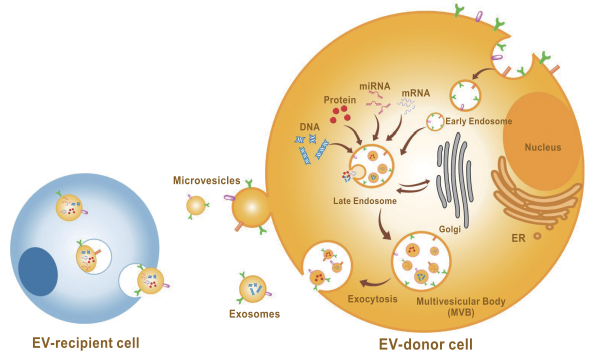
関連製品
細胞外小胞解析試薬
細胞外小胞関連糖脂質
細胞外マトリックス関連試薬
がんの転移は予後不良の大きな原因となっているため、転移の制御はがんの治療に非常に重要です。細胞外マトリックスはがんの浸潤や転移に重要な役割を果たします。その主要な多糖成分であるヒアルロン酸は受容体CD44を介して細胞の遊走などに関わる細胞内シグナル分子を活性化し、がんの進展に関与します30)。
関連製品
関連製品特集ページ
引用文献
- 1) A. Togayachi et al., J. Proteome Res. 2017, 16, 4495.

- 2) D. H. Dube et al., Nat. Rev. Drug Discov. 2005, 4, 477.

- 3) A. Cazet et al., Breast Cancer Res. 2010, 12, 204.

- 4) T. Nakagoe et al., Can. J. Gastroenterol. 2000, 14, 753.

- 5) WHO classification of tumours of the haematopoietic and lymphoid tissues, 4th ed., ed. by S. H. Swerdlow, E. Campo, N. L. Harris, et al., IARC Press, Lyon, 2000, pp. 157-334.
- 6) M. M. Fuster et al., Nat. Rev. Cancer. 2005, 5, 526.

- 7) Structures Common to Different Glycans, in Essentials of Glycobiology, 2nd ed., ed. by A. Varki, R. D. Cummings, J. D. Esko, et al., Cold Spring Harbor Laboratory Press, New York, 2009.
- 8) T. Tai et al., Proc. Natl. Acad. Sci. USA 1983, 80, 5392.

- 9) Y. Kojima et al., J. Biol. Chem. 2000, 275, 15152.

- 10) U. Distler et al., PLoS ONE 2009, 4, e6813.

- 11) S. Hakomori, Acta Anat. (Basel) 1998, 161, 79.

- 12) G. Schulz et al., Cancer Res. 1984, 12, 5914.
- 13) S. Yoshida et al., Cancer Res. 2001, 61, 4244.
- 14) M. Suzuki et al., Expert Opin. Ther. Targets 2015, 19, 349.

- 15) K. Sivasubramaniyan et al., Glycobiology 2015, 25, 902.

- 16) S. Gottschling et al., Eur. Respir. J. 2013, 41, 656.

- 17) Y. Lou et al., Proc. Natl. Acad. Sci. USA 2014, 111, 2482.

- 18) A. Aloia et al., Breast Cancer Res. 2015, 17, 146.

- 19) S. Tokuyama et al., Oncol. Rep. 2003, 10, 1097.

- 20) S. Saito et al., Jpn. J. Cancer Res. 1997, 88, 652.

- 21) F. Ye et al., Int. J. Gynecol. Cancer 2010, 20, 958.

- 22) M. Morita et al., J. Med. Chem. 1995, 38, 2176.

- 23) T. Natori et al., Tetrahedron Lett. 1993, 34, 5591.

- 24) T. Natori et al., Tetrahedron 1994, 50, 2771.

- 25) T. Kawano et al., Science 1997, 278, 1626.

- 26) N. Kamada et al., Int. Immunol. 2001, 13, 853.

- 27) Y. Makino et al., Int. Immunol. 1995, 7, 1157.

- 28) T. Tashiro et al., Trends Glycosci. Glycotechnol. 2010, 22, 280.

- 29) Y. Zhang et al., Front. immunol. 2019, 10, 1126.

- 30) X. Jiang et al., J. Exp. Clin. Cancer Res. 2020, 39, 204.